近年来,肠道微生物群作为人体健康的“隐形器官”备受关注,其在免疫调节、代谢平衡和疾病防御中的作用已被广泛认可。然而,当微生物群的平衡被打破时,可能会引发一系列健康问题,包括感染易感性增加。特别是在严重感染的背景下,肠道微生物群的失调可能不仅是疾病的结果,更可能是疾病发生的潜在驱动因素之一。
谷禾总结发现一些疾病或潜在健康风险人群肠道微生物群存在如下类型的几种失衡的潜在特征:
1
产丁酸菌减少,同时有害菌抬头
2
单一或几种菌属占比过高导致其他核心菌群丰度不足或偏低,尤其产生短链脂肪酸的菌
3
多样性单一或偏低,同时有害菌占比较高或几种机会病原菌超标
4
益生菌缺乏或不足,核心菌丰度占比较低同时构成比例不佳
5
变形菌门或梭杆菌门上升占比太高
以上情况可能单一或同时存在。如果同时存在,一般菌群和健康状况均不佳。
本文主要分享第一个菌群特征,产丁酸菌不足。
先说本文的结论:
肠道微生物群多样性和组成,特别是产丁酸菌丰度较高,与普通人群中因感染住院的风险降低有关。厌氧的产丁酸菌能够在一定程度上保护宿主免受全身性感染的侵害。
该结论的支持证据:
第一 荟萃研究分析和得出的假设验证,分析了10699名参与者的肠道微生物群【4248 (39.7%)来自推导队列,6451(60.3%)来自验证队列】。其中602例(5.6%)受试者【152例(3.6%)来自推导队列; 450例(7.0%)来自验证队列】在随访期间因感染住院或死亡。
这些参与者的肠道微生物群组成与未因感染住院的参与者不同。具体而言,产****丁酸菌的相对丰度较高与感染住院风险降低相关(推导队列每增加10%产丁酸菌的原因特异性风险比为0.75 [95%CI 0.60 - 0.94],p= 0.013;验证队列每增加10%的原因特异性风险比为0.86 [0.77-0.96],p= 0.0077)。在调整人口统计学、生活方式、抗生素暴露和合并症后,这些相关性保持不变。
第二,谷禾的队列和2个独立的欧洲队列
【包括荷兰城市健康生活(HELIUS)研究(推导队列)和芬兰FINRISK 2002年人口调查(验证队列)】。
美国的Kullberg博士团队对在如上两个独立的观察队列中进行了这项研究验证:HELIUS是一项在荷兰阿姆斯特丹进行的多种族、基于人群的前瞻性队列研究。成年人(年龄18-70岁)从阿姆斯特丹市政登记处随机抽样,按种族分层,并邀请参加。HELIUS参与者与国家住院和死亡登记处相关联,涵盖2013年1月1日至2020年12月31日期间所有荷兰医院的入院和死亡情况。FINRISK 2002年队列是一项人口调查,包括来自芬兰六个地区的成年人(年龄25-74岁)的随机样本,按性别、地区和10岁年龄组分层。FINRISK参与者与芬兰医院出院和死亡原因登记册相关联。
在两个队列中,参与者完成问卷调查,接受体格检查,入选时提供粪便样本(HELIUS参与者为2013年1月3日至2015年11月27日,FINRISK参与者为2002年1月21日至4月19日)。在705名HELIUS参与者的子集中提供了饮食变量。为了纳入Kullberg博士团队研究,他们提供粪便样本并成功测序。在Illumina系统上用16S rRNA V4区测序。
感染的现状和研究的分析
目前全球约25%的死亡是由于感染。这一负担凸显了新的预防策略的必要性。因感染性疾病住院的患者经常表现出肠道紊乱,甚至是在抗生素治疗之前。
数据已经表明,这些患者的肠道厌氧菌丰度较低,潜在致病性肠道细菌数量增加。目前尚不清楚这些变化是否是疾病本身的结果(例如由全身性炎症或饮食变化引起),或者肠道****微生物群的破坏从一开始就增加了对感染的易感性。
小鼠模型支持后一种假设,并表明肠道微生物群的扰动(通过使用驱虫处理或无菌小鼠)减弱了炎症反应,并增加了感染的易感性和严重性。微生物组的有益的全身效应通常归因于肠道厌氧菌产生的代谢物。
例如,临床前研究表明,微生物群代谢物丁酸盐增加单核细胞的抗微生物活性,并影响肺中的免疫环境。
结论发现调查分析方法
检索了PubMed从数据库开始到2023年7月10日的数据,没有语言限制,在标题或摘要中使用检索词(“gut”或“intestinal”)AND(“microbiome”或“microbiota”)AND(“infection”或“infectious”)AND“risk”AND(“patients”或“participants”或“cohort”或“men”或“women”)。
本次检索识别出656篇文章。大多数人类研究描述了感染性疾病住院或重症监护病房住院期间的肠道微生物组破坏。
现有证据的结论
研究结果表明,基线肠道微生物群组成(感染发作前)与两个大型独立人群队列中因感染性疾病住院的风险有关,共有10699名参与者和602起事件(即因任何感染性疾病住院或死亡)。
在选定的极易感染的患者人群中(例如,在严重疾病期间或干细胞移植后),微生物多样性丧失、革兰氏阴性菌过度生长和产生短链脂肪酸丁酸的厌氧菌丰度低与(医院获得性)感染风险增加相关。
在这两个队列中,厌氧产丁酸菌的肠道定殖与预防感染性疾病住院有关。通过多变量比例风险模型和匹配病例(因感染住院的参与者)与对照(无感染相关住院的参与者),发现这种关系是稳健的,****而且在调整年龄,性别,种族,生活方式,近期抗生素暴露和合并症后没有改变。
结合临床前研究,谷禾的检测实践和选定的严重感染高风险患者的发现,据我们所知,这是第一个提供证据证明厌氧肠道微生物群对人类一般人群感染易感性的影响。
这些主要结局是在研究入选时采集粪便样本后随访期间因任何感染性疾病而住院或死亡,以HELIUS(5-7年随访)或FINRISK(6年随访)。非传染性疾病导致的死亡被视为**竞争风险。**对于多次因感染入院的参与者,仅考虑第一次入院。
接下来的大型队列的验证
研究小组先前描述了在选定的高感染风险患者(例如,中风或异基因造血干细胞移植后)中,产生丁酸盐的厌氧肠道细菌的消耗与呼吸道感染风险增加之间的关联。厌氧的、产丁酸菌的有益影响可能超出这些高度易感的人群。
大型流行病学研究描述了与没有此类暴露的住院患者相比,在假定微生物群破坏(如艰难梭菌感染或广泛的抗生素治疗)的情况下,住院后因严重脓毒症再次入院的风险高出65-70%。
统计分析
研究详细描述了统计分析方法,并在附录中提供了具体细节。研究主要评估了肠道微生物群的关键特征(包括**群落组成、α多样性和产丁酸菌的相对丰度)**与感染相关住院风险之间的关联。
产丁酸菌的丰度基于16种已知主要产丁酸菌的累积相对丰度计算,其预测粪便丁酸盐浓度的准确性已被独立验证。
敏感性分析包括:
1) 扩展研究范围至所有感染性疾病住院病例,而不仅限于以感染为主要诊断的住院病例;
2) 使用替代的产丁酸菌列表重新计算其丰度。
群落组成的差异通过基于Bray-Curtis距离的多变量方差分析(PERMANOVA)评估,驱动群落差异的细菌则通过DESeq2和ANCOM-BC方法识别。
基于HELIUS队列,研究构建了个体化的微生物群感染相关住院风险评分,并通过正则化Cox回归和10折交叉验证计算每种细菌的权重。随后,在FINRISK队列中验证了该风险评分。
竞争风险回归模型用于评估微生物群特征(多样性、产丁酸菌丰度和风险评分)与感染相关结局之间的关联,计算特定原因风险比(csHR)。
产丁酸菌作为连续变量时,csHR表示其相对丰度每增加10%时的风险变化。研究还进行了嵌套匹配病例对照分析,以比较HELIUS队列中感染相关住院病例与未住院对照的肠道微生物群差异。
多变量模型调整了基线年龄、性别、种族(仅限HELIUS队列)、吸烟、饮酒、身体活动、抗生素暴露(HELIUS为采样前3个月,FINRISK为4个月)以及合并症(如高血压、糖尿病、癌症、心血管疾病、肺部疾病和胃肠道疾病)。
缺失数据极少,并在多变量分析中作为分类变量处理。
队列的结论
对10699名参与者的肠道微生物群进行了表征,其中4248名(39.7%)来自HELIUS研究(推导队列,荷兰),6451名(60.3%)来自FINRISK(验证队列,芬兰),并用于本研究。
在两个队列中,肠道微生物群主要由厚壁菌门和拟杆菌门组成。
从样本采集到2020年12月31日,HELIUS研究的152名(3.6%)参与者因感染性疾病住院或死亡。在FINRISK研究中,450名(7.0%)参与者在6年随访期间因感染住院或死亡。
下呼吸道感染是两个队列中感染相关住院的最常见原因(表1)。
DOI: 10.1016/S2666-5247(24)00079-X
住院/死亡与非住院者肠道菌群是否有差异?
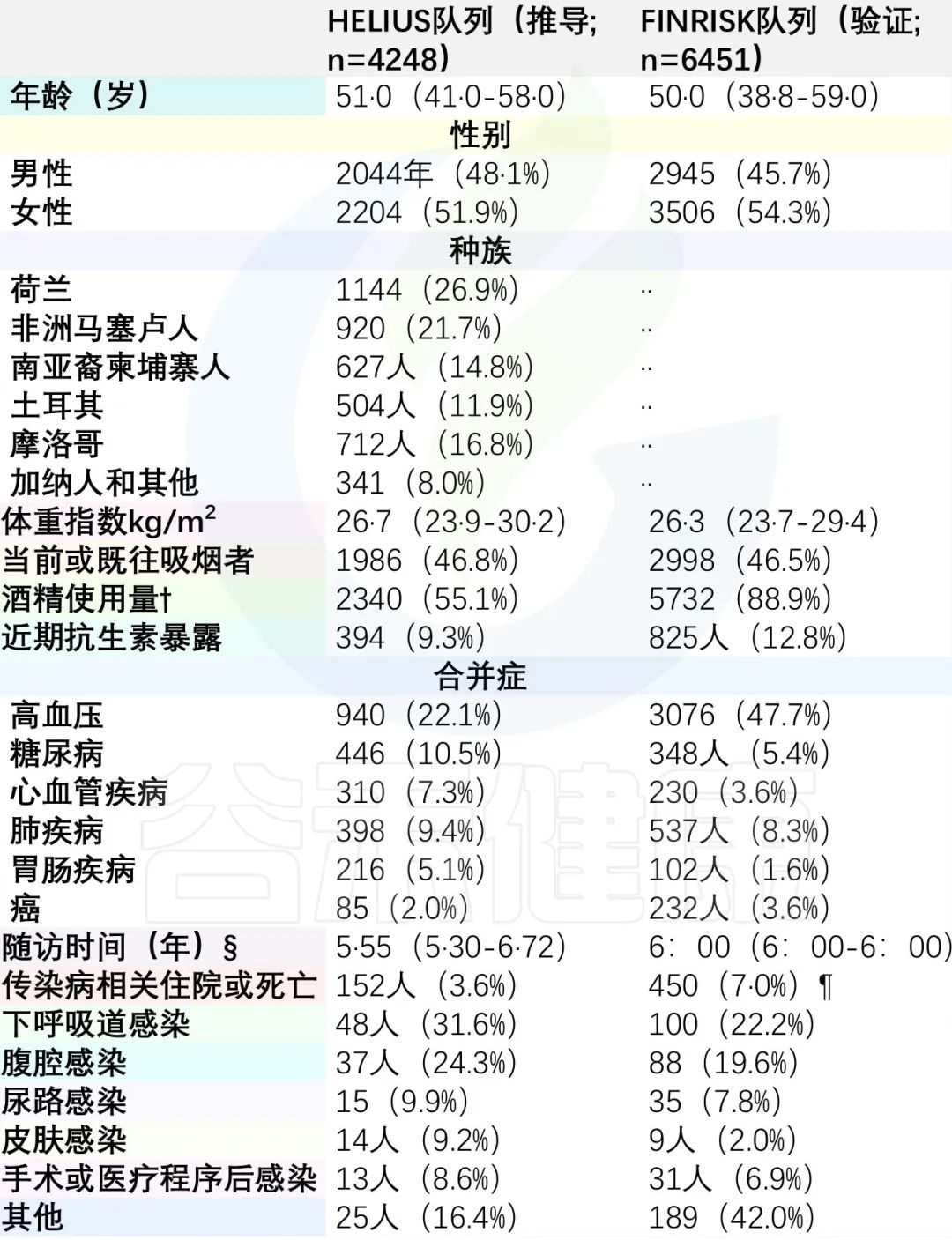
首先检查了因感染住院或死亡的HELIUS参与者与未因感染性疾病住院的参与者(包括死于非感染性原因的参与者)之间肠道微生物群组成是否存在****差异。
这些结果组之间存在可检测的分离(图1A),这通过排列检验(R2=0·00035,p=0·041)在统计学上得到证实。
Kullberg RFJ et al., 2024. Lancet Microbe.
这种分离在更高的分类学水平(属水平p= 0.040;科水平p= 0.024)和遗传学感知距离(加权UniFrac p= 0.040)下是稳健的,尽管效应量很小-即使考虑到多个经典决定因素(人口统计学,饮食,合并症,药物,社会经济和技术因素)通常解释微生物群组成的差异很小(R2= 0.09 - 0.12)。
产丁酸菌的相对丰度与微生物群组成相关,如通过主坐标分析的颜色编码所显示的(p=0·0010;图1B)。
使用DESeq 2模型来识别导致结果组之间差异的特定细菌,发现:
- 因感染住院的参与者中韦荣球菌和链球菌的相对丰度较高。
- 未因感染性疾病住院的参与者具有较高水平的专性厌氧菌(例如,丁酸弧菌; 图1C)。
当使用ANCOM-BC代替DESeq 2时,获得了相似的结果。在验证队列(FINRISK)中,还观察到因感染住院的参与者与未因感染住院的参与者之间的肠道微生物群差异(R2=0·00037,p=0·0002;图1D,E)。
与推导队列一致,来自验证队列的因感染住院的参与者具有较低的丁酸弧菌相对丰度和较高的韦荣氏球菌相对丰度(图1F)。
总之,这些数据表明,在两个独立的队列中,基线肠道微生物群组成在随访期间因感染而住院的参与者和没有感染相关住院的参与者之间存在差异,这同样是由韦荣氏球菌的增加和专性厌氧菌丁酸弧菌的减少所驱动的。
产丁酸菌丰度是否与严重感染风险相关?
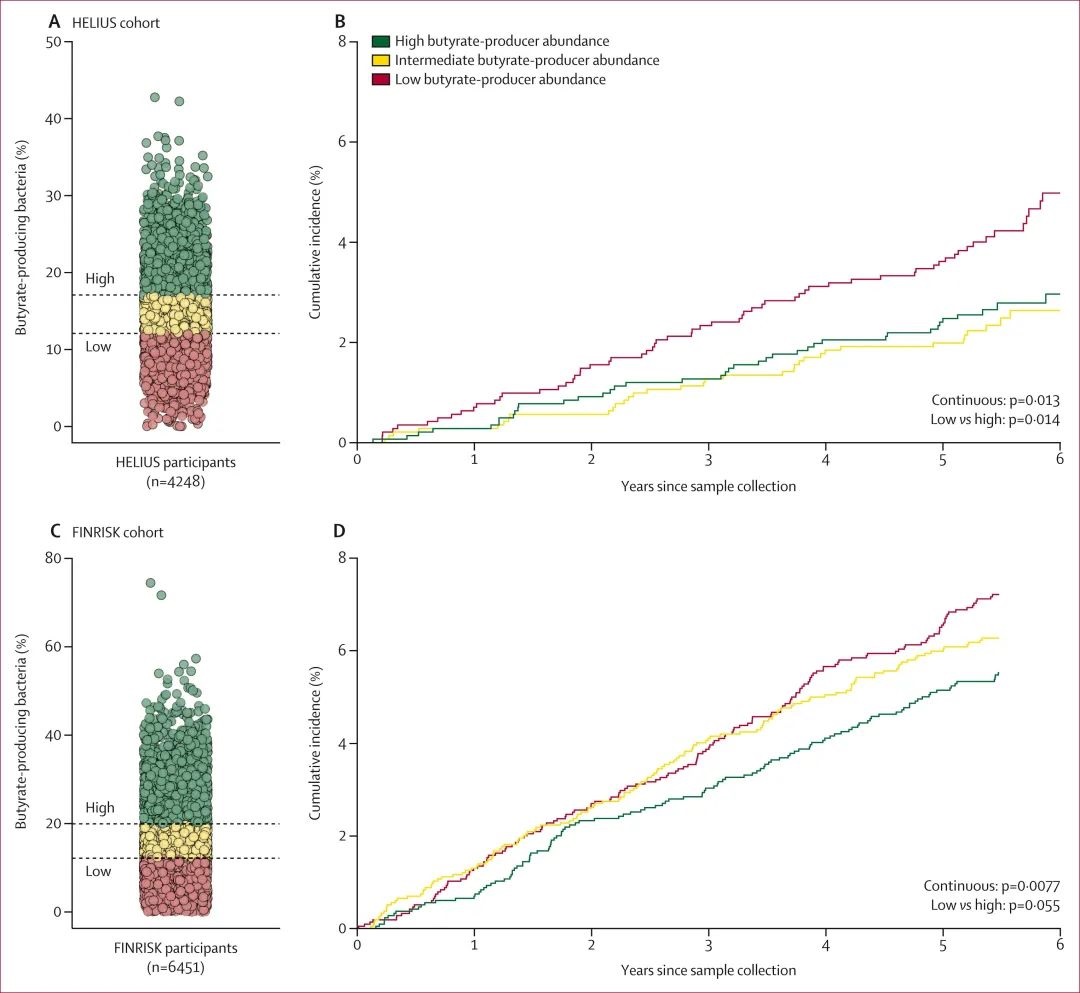
在衍生队列的4248名参与者中,产丁酸菌相对丰度的增加与未来因感染性疾病住院的风险降低相关。换句话说,每增加10%产丁酸菌的相对丰度,感染相关住院的csHR为0.75。
当比较产丁酸菌的三分位数时,也观察到这种关联:最高三分位数的1416名参与者中有42例严重感染,而最低三分位数的1416名参与者中有69例严重感染。
在验证队列中,观察到产丁酸菌相对丰度较高与感染住院风险较低之间存在相同的相关性。在推导和验证队列中,多变量分析中潜在混杂因素(年龄、性别、种族、吸烟、饮酒、体力活动、抗生素暴露和合并症)的校正对效应估计值和显著性均无实质性影响。
鉴于肠道微生物群和肥胖之间的双向关系,BMI不被认为是真正的混杂因素。然而,当BMI额外纳入多变量模型时,相关性未改变。 使用中心对数比转换校正微生物组数据的组成性质也不会影响这些发现。因此得出结论,在推导和验证队列中,产丁酸菌的定植与严重感染风险降低相关。
doi: 10.1016/S2666-5247(24)00079-X.
产丁酸菌相对丰度与感染疾病住院之间关联的多变量病因特异性竞争风险回归分析
在衍生队列的敏感性分析中,任何感染住院均被视为事件**(而不是感染作为主要诊断)。观察到肠道微生物群与感染住院风险之间存在类似关联。此外,使用替代方法重新计算产丁酸菌的相对丰度也得到了与主要分析相似的结果**,显示了微生物群-感染相关性的稳健性。
在衍生队列的嵌套、匹配、病例对照分析中,随访期间因感染住院的HELIUS参与者(病例)与未因感染性疾病住院的HELIUS参与者(对照)在年龄、性别、种族、抗生素暴露、糖尿病以及肺部和胃肠道合并症方面以1:1的比例匹配。病例和对照组的肠道微生物群多样性没有差异。
然而,与整个队列的数据一致,随访期间因感染性疾病住院的参与者与匹配的对照组相比,基线产丁酸菌相对丰度较低,总体肠道微生物群组成不同。
在进一步的探索性分析中,通过计算对比来检查人口统计学、生活方式因素、抗生素和合并症是否改变了产丁酸菌对感染风险的影响估计。
虽然有几个协变量(如性别,年龄,BMI和糖尿病)与产丁酸菌的相对丰度和因感染性疾病住院的风险相关,但产丁酸菌和因**感染性疾病住院之间的关系并不受大多数协变量的影响。**然而,在BMI为30或更高的参与者中,产丁酸菌****与感染相关住院风险之间的关联似乎不存在。值得注意的是,未观察到微生物群-感染关联与种族之间的相互作用,饮食变量也与产丁菌密切相关。
分析与应用
在这些独立的大型观察性队列中,Kullberg博士团队发现肠道微生物群与一般人群中感染性疾病相关住院和死亡的风险相关。更高丰度的厌氧产丁酸菌与预防严重感染有关,即使在调整人口统计学,生活方式,抗生素暴露和合并症时也是如此。
不同地理位置的肠道微生物群与感染相关住院风险之间存在相似的关联。
这些研究结果表明,肠道微生物群可能是感染相关住院治疗的潜在可改变的风险因素,因此有必要进行干预性研究。
肠道微生物群经常在因严重感染住院的患者中被破坏,这与临床结果有关。然而,这些破坏可能是疾病的结果,或者在感染之前并影响易感性。
在感染发作前表征的肠道微生物群在随访期间因感染住院的参与者和那些没有因感染住院的参与者之间存在差异,表明肠道微生物群与严重感染的易感性相关。 在独立的队列中,结果组之间微生物群组成的这种差异同样是由Veillonella (韦荣氏球菌、一种包括与SARS-CoV-2感染期间出现严重症状的风险增加相关的机会性病原体并在COVID-19住院患者中富集的属)增加、Butyrivibrio**(丁酸弧菌、一种产丁酸菌属)和严格厌氧未培养的菌Clostridia Candidatus减少**引起的。
临床前研究表明,微生物代谢产物丁酸盐增强了对感染的保护,同时预防了免疫相关的病理学。丁酸盐诱导抗微生物肽的产生,增加定植抗性,并减少小鼠流感感染期间嗜中性粒细胞向气道的募集,从而限制组织损伤。
研究表明,减少产丁酸菌(仅为严格厌氧菌)会增加中风,肾移植和异基因造血干细胞移植后的感染风险。
此外,2023年发表的一项研究将3032名机械通气患者的观察数据与动物模型相结合,结果显示早期使用抗厌氧抗生素治疗会降低总体和无感染生存率。 在15908名急诊科患者中证实了抗厌氧菌抗生素的这些不良反应。有趣的是,通过**这样的抗生素消耗厌氧微生物群导致肠杆菌科的扩增,**并且先前确定了肠杆菌科相关微生物群特征与一般人群中的全因死亡率之间的关联。
结 语
本文的研究结论有荟萃和大型不同地理位置的独立队列支持。结论的可推广和参考性很强,这些发现表明厌氧、产丁酸盐的肠道微生物群在严重感染高危患者和普通人群中的重要性,并建议应重新考虑广泛使用抗厌氧抗生素。
但是基于这些在单个时间点表征微生物群,考虑肠道微生物群可能会随着时间的推移而变化,这可能会掩盖在遥远的时间点对结果的影响。然而,单个微生物群的组成非常稳定,许多细菌在几十年内都是居民。
此外,产丁酸菌的潜在有益作用可能超出丁酸盐,因为几种产丁酸菌能够生物合成次级胆汁酸和具有潜在免疫调节以及交叉喂养其他共生菌的作用。
本文分享有助于重新评估肠道微生物导向疗法(如靶向输送产丁酸细菌或限制肠道厌氧菌消耗)的干预性的潜在机会,有望降低对全身感染的易感性。
主要参考文献:
Kullberg RFJ, Wikki I, Haak BW, Kauko A, Galenkamp H, Peters-Sengers H, Butler JM, Havulinna AS, Palmu J, McDonald D, Benchraka C, Abdel-Aziz MI, Prins M, Maitland van der Zee AH, van den Born BJ, Jousilahti P, de Vos WM, Salomaa V, Knight R, Lahti L, Nieuwdorp M, Niiranen T, Wiersinga WJ. Association between butyrate-producing gut bacteria and the risk of infectious disease hospitalisation: results from two observational, population-based microbiome studies. Lancet Microbe. 2024 Sep;5(9):100864.
GBD 2019 Antimicrobial Resistance Collaborators. Global mortality associated with 33 bacterial pathogens in 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2022 Dec 17;400(10369):2221-2248.
GBD 2019 Antimicrobial Resistance Collaborators. Global mortality associated with 33 bacterial pathogens in 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2022 Dec 17;400(10369):2221-2248.





 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国