编译:公子欣
在纽约大学朗格尼医学中心实验室里,一组特殊的小鼠正在改写我们对体重调控的认知。这些被基因改造的小鼠,在无法自身合成半胱氨酸并配合食用无半胱氨酸饮食的情况下,短短一周内体重骤降30%。
这项发表在《自然》期刊上的突破性研究发现,半胱氨酸的消耗会破坏哺乳动物细胞将食物转化为能量的正常代谢途径,迫使动物迅速燃烧储存的脂肪,但依然无法满足能量需求。

由纽约大学格罗斯曼医学院研究人员领导的这项研究,揭示了细胞处理碳水化合物和脂肪等燃料(代谢)的关键细节,以及半胱氨酸消耗对组织的影响。实验表明,降低半胱氨酸水平会导致辅酶A(CoA)的小分子水平下降,从而使将碳水化合物和脂肪转化为能量的机制效率降低。
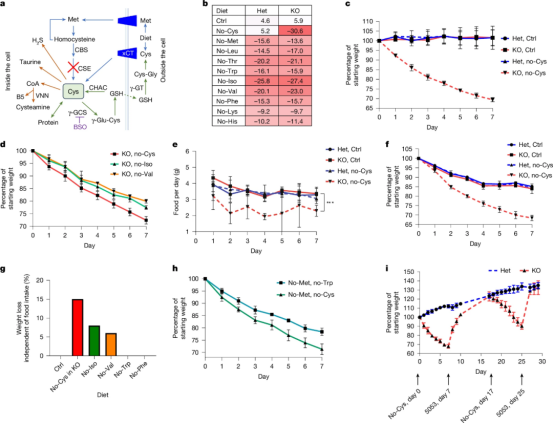
半胱氨酸缺乏导致体重快速下降尽管辅酶A参与100多种中间代谢反应,并作为体内4%酶的辅助因子(辅酶),但科学家此前无法直接研究其功能。这是因为辅酶A合成有缺陷的小鼠通常无法存活超过3周龄。目前的研究结果首次详细阐述了辅酶A如何影响成年小鼠的代谢。
“我们令人惊讶地发现,低半胱氨酸水平通过激活一系列相互关联的生物途径,促使小鼠快速减脂。”该研究共同资深作者、纽约大学格罗斯曼医学院生物化学与分子药理学系Evgeny Nudler博士说。“
尽管在临床上实现减重仍是未来的关键任务,但此刻我们最兴奋的是本研究揭示了新陈代谢的深刻、基础性方面。”Nudler博士补充道。
作者提醒,目前的发现并不意味着立即提出新的减重方法,因为几乎所有食物中都含有半胱氨酸。要实现真正的无半胱氨酸饮食,需要服用一种特殊配方的溶液,这对大多数人来说颇具挑战。此外,由于半胱氨酸参与众多细胞途径,消除它(例如通过抑制半胱氨酸生成的药物)可能会使器官更容易受到日常毒素(包括药物)的侵害。
不过,研究作者表示,值得考虑的是,水果、蔬菜和豆类中半胱氨酸及其前体含硫氨基酸甲硫氨酸的含量远低于红肉。虽然早期研究已将低含硫氨基酸摄入与健康益处联系起来,但本研究明确了这些益处是特指半胱氨酸耗竭所致,而非甲硫氨酸的限制。“
鉴于在小鼠中实现最大程度的半胱氨酸缺乏性减重既依赖于饮食又依赖于基因敲除,未来我们可以对特定细胞或组织进行基因恢复半胱氨酸生成,并确定每个细胞或组织在我们观察到的显著减重中所起的作用。”该研究的共同资深作者、纽约大学格罗斯曼医学院病理学系教授Dan L. Littman博士说。
“我们希望未来能利用这一过程的部分机制,在人类中诱导类似的减重效果,但无需完全去除半胱氨酸。”Littman博士补充道。
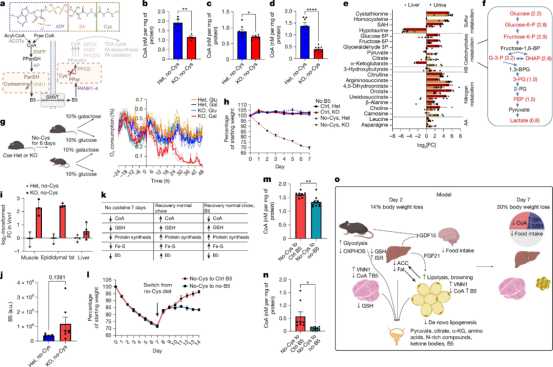
半胱氨酸缺乏通过消耗CoA 导致代谢效率低下
这项开创性研究首次系统评估了半胱氨酸——这一必须通过饮食获取的9种必需氨基酸之一,在哺乳动物体内的独特作用。研究发现,相较于其他必需氨基酸的缺失,半胱氨酸的剔除能引发更为显著的减重效果。
具体来说,半胱氨酸缺乏会直接干扰氧化磷酸化过程——这是细胞生成能量货币三磷酸腺苷(ATP)的核心途径,而该过程高度依赖辅酶A(CoA)的参与。随着能量生产线瘫痪,丙酮酸、乳清酸、柠檬酸和α-酮戊二酸等糖代谢中间产物无法被有效利用,转而通过尿液大量流失。这种“能量危机”迫使机体转向燃烧储存的脂肪来产生能量。
研究团队进一步发现,限制半胱氨酸会同时激活两大应激系统:整合应激反应(ISR)和氧化应激反应(OSR)。整合应激反应是一个信号网络,在细胞经历应激后恢复其平衡状态;氧化应激反应则是由体内主要抗氧化剂——谷胱甘肽耗竭后,活性氧(ROS)水平升高所触发的。活性氧能够氧化(夺取电子)并损伤细胞内敏感的组成部分,如DNA。
令人惊讶的是,这种原先仅在癌细胞中观察到的“双应激共激活”现象,首次在正常组织中显现。而且两种应激反应相互强化,并通过独立于辅酶A耗竭的机制,促使应激激素GDF15产量激增——该激素不仅抑制食欲,还会分解脂肪合成的关键酶乙酰辅酶A羧化酶,从而阻断脂肪储存的补充,形成持续减重的代谢循环。






 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国